تصفیه آب
آب آشامیدنی آبی است زلال، خنک، بی رنگ، بی بو و بدون مزه خاص و عاری از عوامل بیماری زا و سمی. چنین آبی در طبیعت نادر است و اگر چشمه هایی وجود داشته باشد که آب آن ها پاک و خالص باشد کفاف شرب مردم را نمی کند و ضمنا انسان به طور مستقیم و غیر مستقیم باعث آلودگی آب های طبیعی می شود. آب مصرفی هر صنعت نیز باید دارای مشخصات خاص باشد تا به دستگاه ها زیان وارد نشده و محصولات تولیدی کیفیت مرغوبی داشته باشند. از اینرو آب های خام را در اثر یک رشته اعمال تصفیه می نمایند تا آبی با کیفیت مورد نظر بدست آید. پس تصفیه آب یک فرآیند ضروری می باشد.
آب های سطحی تصفیه بیشتری از آب های زیرزمینی لازم دارند. بطور کلی آب های زیر زمینی برای حفظ سلامتی جامعه حداقل باید ضدعفونی شوند ولی برخی از آن ها به تصفیه بیشتری نیاز دارند تا سختی آن ها کاهش یافته یا آهن و سایر ترکیبات که باعث ایجاد لکه، رنگ، مزه و بو می شوند از آب خارج گردند. آب های سطحی را هرگز نباید بدون تصفیه کامل برای شرب مصرف نمود. آب های سطحی علاوه بر ارگانیسم های بیماری زا حاوی کدورت، موجودات آبزی، مانند آلگ ها، و فاضلاب های منازل هستند که با روش صحیح و مناسب تصفیه از آن ها باید خارج شوند.
آب های سطحی یا زیرزمینی اغلب حاوی ناخالصی هایی بوده یا مشخصات نامطلوب دارند. فرآیندهای اصلی تصفیه آب، مانند انعقاد، تجمع ذرات، ته نشینی، صاف کردن و گندزدایی در تصفیه خانه انجام می گیرد. روش هایی به نام تصفیه مقدماتی برای کاهش ناخالصی ها و یا تغییر مشخصات نامطلوب آب قبل از رسیدن به تصفیه خانه وجود دارد که بدین وسیله از فشار بر مراحل اصلی تصفیه آب کاسته می شود.
تصفیه مقدماتی، فرآیندهای فیزیکی، شیمیایی یا مکانیکی هستند که قبل از مراحل اصلی تصفیه آب صورت می گیرد و شامل آشغالگیری، تصفیه شیمیایی مقدماتی، ته نشینی مقدماتی و استفاده از صافی های مشبک سوراخ ریز است.
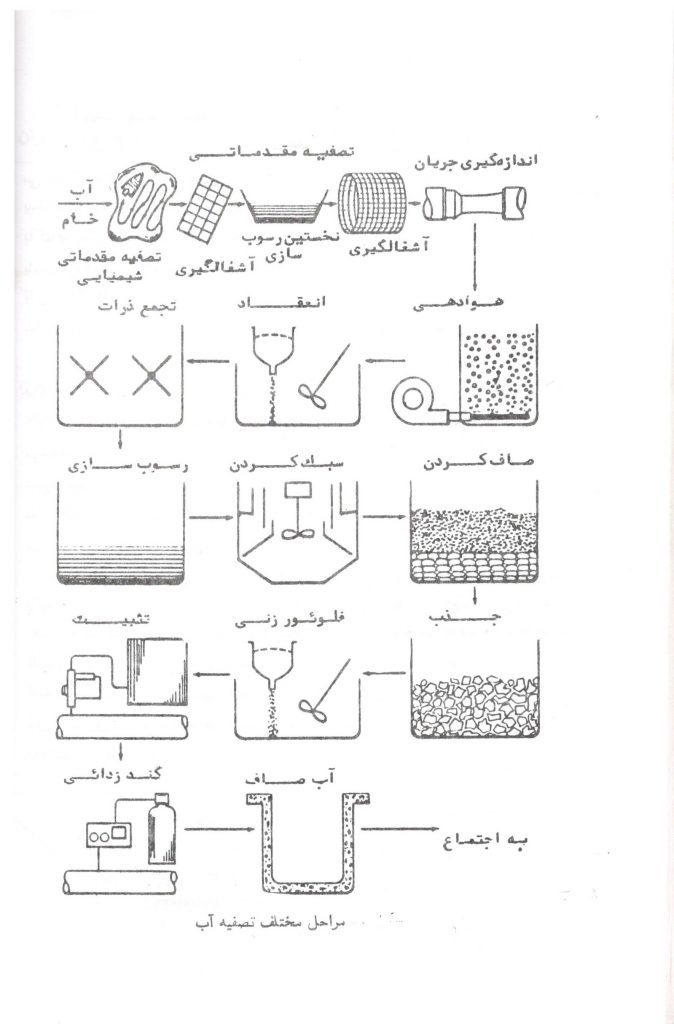
الف – تصفیه آب مقدماتی
-
آشغال گیری
آشغال گیری اولین مرحله تصفیه مقدماتی است که بر روی آب برای تصفیه آب انجام می گیرد و آشغال گیری های مشبک سیمی یا میله ای دهانه فراخ برای گرفتن اجسامی مانند سنگ ها ، چوب ها، کنده های درخت و سایر اجسام که ممکن است به دستگاه های تصفیه خانه یا به عمل تصفیه صدمه وارد سازند، بکار می رود.
-
تصفیه شیمیایی مقدماتی
در این مرحله از مواد شیمیایی برای کنترل رشد گیاهان آبزی استفاده می شود. اگر چه گیاهان آبزی می توانند مشکلاتی برای تصفیه آب بوجود آورند اما باید این نکته مهم را در نظر گرفت که این گیاهان ساکنین عادی و معمولی محیط آبزی بوده و در حفظ و تداوم تعادل اکولوژیکی دریاچه ها و رودخانه ها نقش مهمی دارند.
مشکلاتی که گیاهان آبزی در تصفیه خانه بوجود می آورند نتیجه رشد بیش از حد چند گیاه در مواقع معینی از سال است. بعضی انواع گیاهان آبزی بو و مزه خاص به آب می دهند و بعضی دیگر مشکلاتی در تصفیه خانه بوجود می آورند.
-
ته نشینی مقدماتی
سنگ ریزه، شن، ماسه و سایر مواد ریگ دار آب خام را قبل از ورود به تصفیه خانه در حوضچه هایی به حجم های مختلف بوسیله وزن ثقل جدا می نمایند. ذرات سنگ ریزه دستگاه های تصفیه خانه را مسدود کرده و شن، ماسه و گل و لای از طریق خورندگی باعث انهدام سریع وسایل متحرک غوطه ور در آب، مانند پروانه پمپ ها و پیستون ها می گردند. چنانچه ته نشینی مقدماتی بطرز صحیح و مناسب انجام گیرد تقریبا بیش از 60 درصد مواد قابل ته نشینی از آب جدا می شوند.
-
صافی های مشبک سوراخ ریز
از این نوع صافی ها برای گرفتن آلگ ها، سایر موجودات آبزی و اجسام کوچک استفاده می شود. یکی از مزایای عمده صافی های مشبک بهبود کارایی صافی های شنی می باشد. معمولا صافی های مشبک حدود 65% مواد مسدود کننده صافی ها را از آب خارج می نمایند و بدین وسیله صافی ها زمان بیشتری بکار می روند و از دفعات شستشوی آنها نیز کاسته می گردد.
-
اندازه گیری جریان آب
جریان آب بعد از خروج از بخش تصفیه مقدماتی تصفیه آب و قبل از ورود به تصفیه خانه اندازه گیری می شود تا اطلاعات لازم مانند کنترل جریان آب ورودی به قسمت های مختلف تصفیه خانه، تنظیم مقدار مواد شیمیایی، تعیین کارایی پمپ ها و الکتریسیته مورد نیاز، محاسبه زمان باقی ماندن آب در مراحل مختلف تصفیه، تنظیم مقدار آب تصفیه شده و محاسبه هزینه تصفیه یک واحد آب ، برای مسئولین فنی تهیه گردد.
ب- هوادهی
در تصفیه خانه اغلب هوادهی اولین فرآیند تصفیه آب است. هوا را با آب مخلوط می کنند تا بعضی گازهای محلول، مانند دی اکسید کربن، هیدروژن سولفوره و متان از آب خارج شده و غلظت اکسیژن محلول آب که برای اکسیداسیون فلزات محلول، مانند آهن و منگنز، به اکسیدهای نامحلول لازم است افزایش یابد.
پ – انعقاد و تجمع ذرات
یک روش شیمیایی تصفیه آب است که مواد شیمیایی مختلف مانند سولفات آلومینیوم، سولفات مس، سولفات فرووفریک، آلومینات سدیم را به مقادیر لازم و کافی به آب اضافه می کنند تا ذرات کوچک، سبک و غیر قابل ته نشین به ذرات بزرگتر و سنگین تر تبدیل شده و به آسانی ته نشین شوند. انعقاد و تجمع ذرات باید قبل از مرحله ته نشینی انجام گیرد تا ذرات معلق و کلوئیدی آب بآسانی ته نشین گردند.
مواد غیر قابل ته نشین آب به دو دلیل اساسی در برابر ته نشینی مقاومت می نمایند:
- اندازه ذرات
- نیروهای طبیعی میان ذرات
آب های طبیعی تصفیه نشده سه نوع ذرات غیر قابل ته نشین دارند که از بزرگترین به کوچک ترین عبارتند از :
- ذرات معلق
- ذرات کلوئیدی
- مواد محلول
ت- ته نشینی
تلاطم و سرعت جریان آب، شن، سنگ ریزه، رسوبات شیمیایی، آلوده کننده ها، ذرات و سایر اجسام و مواد غیر قابل ته نشین را به صورت معلق در آب نگه می دارد. مواد معلق در آب به کمک ته نشینی از آب جدا می شوند تا فشار بر صافی ها و سایر مراحل تصفیه آب کاهش یابد. آب را با سرعت خیلی آهسته ای در حوضچه هایی وارد می کنند تا خرده های آن ته نشین شوند و یا ممکن است حوضچه ها پهلوی یکدیگر ساخته شوند و آب از حوضچه های به حوضچه بعدی با سرعت مناسب جریان یابد
ث- سبک کردن آب
مقادیر مواد محلول آب ها متفاوت است که بعضی از آن ها، مخصوصا کلسیم و منیزیم، باعث سختی آب می شوند. با وجود اینکه بطور کلی مواد شیمیایی که باعث سختی آب می گردند برای سلامتی مصرف کنندگان مضر نمی باشند اما با تشکیل رسوب و پوسته در لوله ها، لوازم منزل ( مخصوصا آب گرم کن ها ) و لایه صابون بر روی وان حمام ها و دستشویی ها باعث شکایت مصرف کنندگان می شوند.
ج- صاف کردن
هدف اصلی صاف کردن آب جدا کردن مواد معلق است. مواد معلق شامل ذرات تشکیل یافته در عمل انعقاد، تجمع ذرات ته نشینی، میکروارگانیسم ها، رسوباتی مانند کربنات کلسیم که بعد از سبک کردن آب های سطحی یا زیرزمینی با آهک یا آهک – کربنات سدیم در آب باقی می ماند و رسوبات آهن و منگنز از منابع آب های زیرزمینی می شود.
این مواد معلق هنگام عبور آب از بستر صافی که معمولا از شن یا مخلوطی از شن، ذغال آنتراسیت و لعل ریز، یا مواد مصنوعی مشابه که مخصوص تصفیه آب است از آب جدا می شوند.
معمولا در تصفیه خانه صاف کردن بعد از انعقاد، تجمع ذرات و ته نشینی انجام می گیرد.
کاهش کدورت آب در حفظ سلامتی و بهداشت مردم و جلوگیری از مشکلات و مسائل سیستم توزیع آب مهم است. کدورت با فرآیند گندزدایی تداخل می نماید زیرا که به صورت حفاظی مانع اثر ماده ضدعفونی کننده بر میکروارگانیسم ها می شود. بعلاوه، ذرات با ماده گندزدا ترکیب شده و غلظت آنرا کاهش می دهند و در صورت که مقدار عامل گندزدا جریان گردد بدین وسیله بر هزینه گندزدایی آب افزوده می گردد. همچنین کدورت، رسوباتی در لوله های توزیع آب ایجاد می کند که موجب بو، مزه و رشد میکروب ها می شود.
چ- جذب
یکی از اهداف عمده اصلی تصفیه آب تهیه آب صاف و گوارا است. سال های متمادی روش جذب برای جدا کردن مواد آلی که رنگ، بو، و مزه تولید می کنند بکار رفته است تا آبی صاف و گوارا در اختیار مردم قرار گیرد. اخیرا از روش جذب برای جدا کردن مواد آلی سمی از آب های مشروب استفاده می شود. آب های خام مقادیر متفاوتی مواد آلی محلول دارند که معمولا غلظت آن ها در آب های سطحی بیشتر از آب های زیرزمینی است. بعضی از این مواد آلی، مانند مواد هومیک، در طبیعت یافت می شوند و تعداد زیادی از آن ها هم از طریق سیلاب ها، فاضلاب های شهری، صنعتی و کشاورزی وارد آب های سطحی یا زیرزمینی می گردند.
ذغال فعال را در تصفیه آب به صورت پودر یا گرانول بکار می برند که پودر آنرا به صورت خشک یا مخلوط با آب خام می افزایند و گرانول آنرا در بستر صافی یا در یک ستون بسته جداگانه که تحت فشار کار می کند، قرار می دهند.
ح- فلوئوریداسیون
عبارت است از افزایش ترکیبات مختلف فلوئور، مانند فلوئورسدیم، اسید هیدروفلوئوسیلیسیک و سیلیوفلوئور سدیم، به آب آشامیدنی تا غلظت مجاز فلوئور که پوسیدگی و فساد دندان اطفال را کاهش دهد.
خ- تثبیت
هدف از تثبیت آب کنترل خورندگی و تشکیل رسوب و پوسته آب های شرب قبل از ورود به شبکه توزیع آب است. آب های بی ثبات ایجاد مشکلات بهداشت عمومی، اقتصادی و زیبایی می نمایند. آب های شرب خورنده فلزات سمی سیستم توزیع، مانند سرب و کادمیوم را حل می نمایند. خورندگی لوله های آهنی اصلی سیستم توزیع باعث تشکیل رسوبات آهن بنام توبرکول می شود که میکروارگانیسم ها را در برابر کلر باقی مانده حفظ می نماید و تغییرات فشار و سرعت آب در لوله اصلی باعث رهایی میکروارگانیسم ها به داخل آب و انتشار بیماری های مختلف می شود. بعضی از باکتری ها هم نیز فرآیند خورندگی لوله ها را تسریغ می نمایند.
روش های اساسی تثبیت آب یا حفظ شبکه توزیع آب در برابر آب های بی ثبات عبارتند از :
- تنظیم pH و قلیاییت آب
- مصرف عوامل چنگک و جلوگیری کننده خورندگی
- استفاده از پوشش های حفاظتی
مهمترین ناخالصی های آب و نحوه حذف آن ها
| نوع ناخالصی | اشکالی که تولید می نماید | نحوه حذف آن |
|---|---|---|
| کدورت | بد منظره کردن آب - ترسیب در لوله ها و کانال ها - تداخل در روش های تصفیه | کواگولاسیون - ته نشینی و صاف کردن |
| رنگ | کف در دیگ های بخار - ممانعت از ترسیب آهنی - فسفات - باقیماندن در محصولات صنعتی | کواگولاسیون - ته نشینی و صاف کردن و استفاده از ذغال فعال |
| سختی کل | ایجاد رسوب در وسایل مبادله حرارتی - دیگ های بخار - لوله های انتقال آب گرم - تداخل در رنگرزی | سبک کردن با روش های گوناگون - استفاده از مواد با فعالیت سطحی |
| قلیائیت | ایجاد کف و انتقال مواد جامد در دیگ های بخار - تولید شکنندگی قلیائی تولید دی اکسید کربن بعلت تجزیه کربنات و بی کربنات | سبک کردن به کمک آهک و کربنات سدیم - مبادله یونی سیکل هیدروژن - حذف قلیایی با رزین آنیونی |
| گاز کربنیک | خوردگی در لوله های انتقال آب و بخار | هوادهی - تهویه - خنثی کردن با مواد قلیایی |
| pH | ایجاد خاصیت اسیدی یا قلیایی در آب | خنثی کردن با افزودن اسید یا قلیا |
| سولفات | بالا بردن مواد جامد محلول آب که املاح کلسیم و منیزیم آن حتما عمومی است | تقطیر |
| کلرور | بالا بردن مواد جامد محلول آب که املاح کلسیم و منیزیم آن حتما عمومی است | تقطیر |
| نیترات | از نظر صنعتی مهم نیست - غلظت زیاد در مصرف کنندگان خردسال متهموگلوبین بوجود می آورد | تقطیر |
| فلوئور | زیادی آن دندان ها را مخطط و کمی آن تسریع پوسیدگی را باعث شده ولی از نظر صنعتی مهم نیست | جذب با هیدروکسید منیزیم یا فسفات کلسیم یا کوآگولاسیون با زاج |
| سیلیس | رسوب در دیگ های بخار و لوله های سرد کننده و پره های توربینی و تبخیر کننده ها | املاح منیزیم - جذب در رزین های آنیونی قلیایی - تقطیر |
| آهن و منگنز | رنگ در آب ها - ترسیب در لوله های آبرسانی - دیگ های بخار - تداخل در رنگرزی و تهیه کاغذ و لباسشویی | هوادهی - کوآگولاسیون و صاف کردن - سبک کردن با آهک - رزین های کاتیونی - جذب به کمک بعضی از مواد |
| نفت | ترسیب - کف در دیگ بخار - اشکال در مبادله حرارت - ایجاد اشکال در اغلب روش ها | جدا کرد با مانع - کوآگولاسیون و صاف کردن صافی دیاتومه |
| اکسیژن | خوردگی در لوله های آب و بخار | ایجاد خلا - سولفیت سدیم - ممانعت کننده ها از خورندگی |
| آمونیاک | خوردگی لوله های مسی - آلیاژهای رویی | مبادله کاتیونی - سیکل هیدروژنی - کلرزنی خلا |
| هیدروژن سولفوره | بوی تعفن و خوردگی | هوادهی- کلرزنی - مبادله یونی آنیونی |
| مواد محلول | در مقادیر بالا از کاربرد آب در موارد مختلف می کاهد | روش های مختلف سبک کردن - تقطیر |
| مواد معلق | ترسیب در مسیرهای جریان آب | کوآگولاسیون - فلوکولاسیون - ته نشینی - صاف کردن |
د- گندزدایی
گندزدایی آب ها برای از بین بردن میکروارگانیسم های بیماری زا انجام گیرد. اکثر عوامل بیماری زا به زندگی در درجه حرارت و شرایطی که در بدن انسان و حیوانات یافت می شود عادت کرده اند و خارج از بدن خوب زنده نمی مانند. با این وجود، تعداد قابل توجهی از آن ها در آب های قابل شرب زنده می مانند. برخی عوامل بیماری زا، مخصوصا بعضی ویروس ها و ارگانیسم هایی که تشکیل کیست می دهند، حتی تحت شرایط نامطلوب برای مدت طولانی زنده می مانند. چون این موجودات به مقدار کلری که معمولا برای ضدعفونی آب مصرف می شود مقاوم هستند، بنابراین کلرزنی همیشه به تنهایی آب آشامیدنی سالم بوجود نمی آورد. ذخیره سازی آب در تانک ها یا مخازن قبل از تصفیه از طریق ته نشینی و مرگ طبیعی ارگانیسم ها منجر به نابودی بعضی بیماری زاها می شود. ضمنا، تعداد قابل توجهی از بیماری زاها در فرآیندهای انعقاد، تجمع ذرات، ته نشینی و صاف کردن تصفیه آب از بین می روند.
تمام آب های آشامیدنی باید گندزدایی شوند و چون آب های سطحی بیشتر از آب های زیر زمینی در معرض آلودگی با عوامل بیماری زا می باشند بنابراین همیشه باید قبل از گندزدایی و مصرف، تصفیه مانند انعقاد، تجمع ذرات، ته نشینی و صاف کردن شوند.
اگر چه کلرزنی متداول ترین روش گندزدایی آب است ولی روش های گندزدایی دیگری نیز وجود دارند که ممکن است در بعضی شرایط مفید واقع شوند.
سه دسته عمومی گندزدایی عبارتند از :
- تصفیه حرارتی : احتمالا حرارت اولین روش گندزدایی آب های قابل شرب بوده است و هنوز هم در مواقع فوری روش مناسبی برای گندزدایی مقادیر کم آب است که آب به مدت 5 تا 20 دقیقه می جوشانند. مدت جوشانیدن آب به ارتفاع بستگی دارد و در ارتفاعت بالاتر مدت زمان بیشتری برای جوشانیدن لازم است زیرا که درجه حرارت جوش پایین تر می باشد. از این روش در اردوگاه ها، یا مواقعی که اشکالی در سیستم توزیع آب شهر پیش می آید در منازل استفاده می شود.
- تصفیه پرتوافکنی : نور خورشید یک وسیله طبیعی گندزدایی است که طول موج های بنفش آن میکروارگانیسم ها را از بین می برد. اشعه ماورابنفش از لامپ های مخصوص نیز تولید می شود که به علت گرانی مصرف کمی در گندزدایی آب دارد. چون اشعه ماورابنفش به آسانی بوسیله ناخالصی هایی که باعث کدورت آب می گردند جذب یا پراکنده می شود، بنابراین قدرت کشندگی بیماری زاهای آب که از نزدیک لامپ تولید کننده اشعه ماورابنفش عبور نکنند بسیار کاهش می یابد. این معایب و عدم وجود اشعه باقیمانده قابل اندازه گیری مانع مصرف وسیع اشعه ماورابنفش شده است.
- تصفیه شیمیایی : برم، ید، ازن و کلر و ترکیبات کلر از مواد شیمیایی هستند که برای گندزدایی آب ها مصرف می شوند.
رده بندی آب ها برحسب درجه آلودگی آن ها
| نوع آب | BOD(mg/Lit) | نوع آب )( | BOD(mg/Lit) |
|---|---|---|---|
| آب آشامیدنی ( آب خالص ) | 0 | آب نیمه کثیف | 8 |
| آب کاملا تمیز | 1 | آب خیلی کثیف | 20 |
| آب نسبتا تمیز | 3 | فاضلاب خانگی رقیق | 200 |
| آب رودخانه تمیز | 1 تا 3 | فاضلاب خانگی متوسط | 300 |
| آب رودخانه متوسط | 3 تا 5 | فاضلاب خانگی غلیظ | 400 |
| آب رودخانه کثیف | 5 تا 8 | فاضلاب های صنعتی | 200 تا 5000 |
کیفیت آب برای مصارف گوناگون
آب در صنعت کاربردهای فراوانی دارد از این رو کیفیت آن برای مصارف مختلف متفاوت و حائز اهمیت است مثلا آب تغذیه دیگ بخار، آب آشامیدنی، آب برج خنک کن، آب سیستم گرمایش، آب برای تولید بتن، پرورش ماهی، حیوانات، گیاهان و غیره هر کدام از آن ها نیاز به آبی با شرایط خاص خود دارد.
کیفیت آب آشامیدنی دام ها براساس TDS
| TDS (ppm ) | کیفیت آب |
|---|---|
| TDS<1000 | مناسب برای کلیه دام ها و پرندگان |
| TDS<3000 TDS>1000 | بسیار رضایت بخش برای کلیه دام ها و پرندگان. در دام هایی که عادت به آشامیدن چنین آبی ندارند ممکن است باعث اسهال موقتی و خفیف و در پرندگان سبب فضولات آبکی شود |
کیفیت آب پرورش ماهی
| اکسیژن آب | برای ماهیان خاویاری نباید از 8mg/Lit کمتر باشد. برای ماهیان کپوری نباید از 4mg/Lit کمتر باشد. |
|---|---|
| دمای آب | مناسب ترین دما برای ماهیان گرم آبی 15-25 درجه سانتی گراد مناسب ترین دما برای ماهیان سرد آبی 15-18 درجه سانتی گراد |
| pH | 7-8 |
| گاز کربنیک | کمتر از 5mg/Lit |
| TDS آب | حد مناسب 2000mg/Lit |
| سختی آب | حد مناسب 200mg/Lit |
| شوری آب | شوری آب استخرها نباید از 3000mg/Lit بیشتر شود |
| ازت | 2mg/Lit-3mg/Lit |
| فسفر | کمتر از 0.5mg/Lit |
| گازهیدروژن سولفوره | کمتر از 1mg/Lit |
استاندارد كيفيت منبع آب برای کاربری شرب برای سه گروه آب بهشرح زیر در جدول زیر ارائه شده است.
- گروه 1: برای آبی که پس از تصفیه فیزیکی و گندزدایی ساده مانند فیلتراسیون سریع و گندزدایی قابل شرب خواهد بود.
- گروه 2: برای آبی که پس از تصفیه فیزیکی معمول، تصفیه شیمیایی و گندزدایی مانند پیش کلرزنی، انعقاد و لختهسازی، تهنشینی، فیلتراسیون و گندزدایی قابل شرب خواهد بود.
- گروه 3: برای آبی که پس از تصفیه شیمیایی و فیزیکی پیشرفته، تصفیه و گندزدایی گسترده (مانند کلرزنی تا نقطه شکست)، انعقاد، لخته سازی، تهنشینی، فیلتراسیون، جذب سطحی (کربن فعال) و گندزدایی قابل شرب خواهد بود.
| ردیف | پارامتر | واحد | گزارش | گروه 1 | گروه 2 | گروه 3 |
|---|---|---|---|---|---|---|
| 1 | pH | رقم pH آب یا غلظت یون های هیدروژن، اسیدیته یا قلیاییت آب را مشخص می کند. pH یکی از مهم ترین خواص فیزیکیو شیمیایی آب می باشد زیرا که بیشتر روش های تصفیه آب به pH آن بستگی دارد. آب خالص به میزان خیلی کم به یون های H+ و OH- تجزیه می شود. در اصطلاح عمومی به محلولی خنثی گویند که تعداد یون های هیدروژن و هیدروکسیل آن برابر باشد. وقتی که غلظت یون های هیدروژن بیش از هیدروکسیل باشد و در pH کمتر از 7، آب دارای خاصیت اسیدی بوده و برعکس اگر غلظت یون های هیدروکسیل بیش از هیدروژن باشد و در pH بالاتر از 7، آب خاصیت قلیایی خواهد داشت. pH آب آلوده نشده اساسا رابطه بین دی اکسیدکربن آزاد و مقدار کربنات و بیکربنات را نشان می دهد. آب های طبیعی معمولا دارای pH بین 4 تا 9 می باشند و اکثر آنها به علت انحلال کربنات ها و بی کربنات های قلیایی پوسته زمین کمی قلیایی می باشند. آب های اسیدی که از معادن ذغال سنگ می گذرند pH پایین داشته و دارای خاصیت خورندگی زیاد و طعم اسیدی یا نمکی می باشند. آب های سخت که از زمین های آکی می گذرند pH بالایی دارند. | 5/8-5/6 | 5/5-9 | 5/5-9 | |
| 2 | رنگ (پس از صاف کردن نمونه) | میلیگرم (برحسب پلاتین) | رنگ آب آلوده نشده می تواند از مواد در حال گندیدگی زمین و یا نمک های فلزی موجود در طبیعت ( معمولا آهن و منگنز ) ناشی شود. آب های حاوی آلودگی های صنعتی می توانند طیف وسیعی از مواد رنگ کننده داشته باشند. رنگ آب معمولا به واحد هازن که همان مقیاس پلاتین – کبالت است، بیان می شود. آب غالبا در اثر مواد معلق در خود رنگی بنظر می رسد، ولی رنگ واقعی آن فقط پس از انجام عملیاتی چون صاف کردن ظاهر می گردد. میزان غیر قابل قبول نبودن رنگ آب بیشتر در ارتباط با عادت مصرف کننده قرار دارد. طبق استاندارهای بین المللی سازمان بهداشت جهانی 1971 میزان رنگ مورد قبول آب 5 واحد و حداکثر میزان مجاز برابر 50 واحد می باشد. دستورالعمل های مجمع اروپایی مقدار کمتری را پیشنهاد می کند که معادل 1 میلی گرم در لیتر طبق مقیاس پلاتین – کبالت می باشد اما در مورد آب های بیشماری امکان کاربرد این استاندار مقدور نیست و یا اصولا ضرورتی ندارد. | 20 | 100 | 200 |
| 3 | هدایت الکتریکی | میکروزیمنس بر سانتیمتر در 20 درجه سیلسیوس | قابلیت هدایت الکتریکی معیاری است جهت سنجش توانایی یک محلول برای انتقال الکتریکی، از آنجایی که این توانایی تابعی از حضور یون های موجود در یک محلول می باشد. اندازه گیری قابلیت هدایت الکتریکی نشانگر خوبی در مورد کل مواد حل شده در آب بشمار می آید. واحد قابلیت هدایت الکتریکی میکروزیمنس بر سانتی متر می باشد. در مورد غالب آبها فاکتورهای برابر 0.55-0.7 در نظر گرفته می شود که با ضرب کردن این فاکتور در میزان قابلیت هدایت الکتریکی، مقدار مواد حل شده به میلی گرم در لیتر را بطور تقریب می توان بدست آورد. این فاکتور در مورد آبهای حاوی اسید آزاد کمتر از 0.55 است و برای آب های پر نمک، بیش از 0.7 می باشد. قابلیت هدایت الکتریکی تابعی است از حرارت که در موقع اندازه گیری آن باید درجه حرارت ( معمولا 20 یا 25 درجه سانتی گراد ) قید شود. | 1000 | 2000 | -- |
| 4 | بو | فاکتور رقیقسازی در 25 درجه سیلسیوس | اساسی ترین مساله در مورد آب تصفیه شده عدم داشتن بو و طعم می باشد. بوی آب قاعدتا باید ارتباط نزدیکی با طعم آن داشته باشد، در صورتی که عوامل غیر فراری مثل کلرور سدیم وجود دارند که با تاثیر بر روی طعم آب، هیچگونه اثری بر بوی آن نمی گذارد. عوامل مختلفی در ایجاد طعم و بوی آب موثرند از جمله : جلبک ها، تجزیه گیاهان آبزی، محصولات حاصل از کلرینه کردن آب مثل کلروفنل ها و آب های راکدی که در انتهای سیستم توزیع ساکن می مانند. ذائقه انسان چهار نوع طعم اصلی، شیرین، شور، تلخ و ترش را تشخیص داده و شناسایی طعم های دیگر از طریق مقایسه با احساسی که از چشیدن اجسامی که روزانه با آن ها در تماس است، انجام می گیرد. در مورد بوی آب نیز از استاندارهای بوی اجسامی که شناسایی آن ها برای عموم مقدور است استفاده می شود. | 3 | 10 | 20 |
| 5 | نیترات | میلی گرم در لیتر | نیتریت و نیترات معمولا براساس میلی گرم در لیتر برحسب ازت بیان می شوند. کل ازت اکسید شده برابر با مجموع ازت نیتریت و نیترات می باشد. نیتریت مرحله میانی اکسیداسیون ازت، در اکسید شدن بیوشیمیایی آمونیاک و تبدیل آن به نیترات می باشد، همچنین در عمل احیا نیترات در شرایطی که کمبود اکسیژن وجود داشته باشد، تشکیل می شود. آب های سطحی بندرت بیش از 0.1 میلی گرم در لیتر برحسب ازت، نیتریت دارند، مگر اینکه بشدت با فاضلاب آلوده شده باشند. بنابراین حضور نیتریت همراه با میزان بالایی از آمونیاک در آب های سطحی نشان دهنده آلودگی آب با فاضلاب می باشد. در مناطق آهن دار، نیترات های موجود در آب های زیرزمینی می تواند به نیتریت احیا شود، چنین واکنشی در آجر کاری های جدید دیواره چاه ها نیز صورت می گیرد و در نتیجه آن نیتریت وارد آب چاه می گردد. نیترات آخرین مرحله اکسیداسیون آمونیاک و معدنی شدن ازت حاصل از مواد آلی بشمار می آید. این عمل اکسیداسیون در خاک و آب بیشتر توسط باکتری های نیتریفیکاسیون صورت می گیرد و فقط می تواند در یک محیط با اکسیژن فراوان انجام شود. باکتری های مشابه در صافی پالاینده تصفیه خانه های فاضلاب ها فعالیت می کنند که نتیجه آن مقدار زیادی نیترات می باشد. افزایش کاربرد کودهای شیمیایی ازت دار در چند دهه اخیر باعث افزودن نیترات در آب های سطحی و زیرزمینی شده است. میزان نیترات در آب های سطحی غالبا تحت تاثیر تغییرات فصلی بوده، بدینگونه که در ماه های زمستان در مقایسه با تابستان غلظت های بیشتری مشاهده گردیده است. با آغاز باران های زمستانی و کاهش فعالیت بیولوژیکی در رودخانه ها، نیترات آب افزایش یافته و منجر به زیاد شدن غلظت آن می گردد. در طول تابستان احتمالا میزان نیترات در اثر جذب و اعمال بیوشیمیایی جلبک ها کاهش می یابد و علاوه بر این عدم نیتریفیکاسیون باکتریایی و احیای غیر هوازی نیترات به ازت در سطح گل و لای ته نشین شده در مخازن، غلظت نیترات را در آب کاهش می دهد. آبی که دارای غلظت بالایی از نیترات باشد بالقوه برای شیرخواران و کودکان مضر می باشد. باکتری های موجود در دستگاه گوارش می توانند نیترات غذا و آب را به نیتریت احیا کنند، سپس نیتریت جذب جریان خون شده و هموگلوبین را تبدیل به مت هوگلوبین می نماید. مت هموگلوبین با اینکه بالقوه سمی نیست ولی کاهشی را که در ظرفیت حمل اکسیژن توسط هموگلوبین می دهد اثرات جدی ببار می آورد بویژه در شیر خواران که در بدنشان حجم زیادی مایع نسبت به وزن دارند. نیتریت حاصل از احیای نیترات توسط باکتری ها، در دستگاه گوارش با آمین های نوع دوم و سوم ترکیب شده و تشکیل نیتروزآمین می دهد که این ماده سرطان زا می باشد. | 50 | 50 | 50 |
| 6 | فلوراید | میلی گرم در لیتر | فلوئر ممکن است بطور طبیعی در آب وجود داشته باشد و یا در طول تصفیه به اندازه کنترل شده به آب اضافه شود. امروزه این واقعیت در کل مورد قبول قرار گرفته که افزودن فلوئور به آب آشامیدنی به میزان یک میلی گرم در لیتر ، هم سالم و هم برای کاهش فساد دندان موثر می باشد. چنانچه آب فلوئردار در زمان کودکی و در طول دوران دندان درآوردن مصرف شود، احتمال فساد دندان کاهش می یابد. غلظت فلوئور باید دقیقا کنترل گردد، زیرا مقدار اضافی آن می تواند بیماری هایی چون فلوئوروزیس یعنی خط افتادن روی دندانها و یا آسیب های استخوانی هم در کودکان و هم در بزرگسالانبوجود آورد. بنابراین غلظت مناسب فلوئور باید در رابطه با شرایط آب و هوا و مقدار آب مصرفی قرار داده شود. روش های تصفیه ای خاصی برای خارج ساختن فلوئور اضافی از آب می توان بکار برد که همراه با هزینه های گزاف می باشد. افزودن فلوئور به آب مصرفی مساله ای است که خیلی ها آن را نمی پذیرند. میزان فلوئور مورد نیاز برای جلوگیری از پوسیدگی و همچنین ممانعت از مخلط شدن دندان ها را 0.6 تا 1.7 میلی گرم در لیتر نوشته اند. | 1/5 | 1/5 | 1/5 |
| 7 | آهن محلول | میلی گرم در لیتر | آهن در غالب آب های خام و مقدار ناچیزی از آن معمولا در شبکه های آبرسانی در جایی که آب در تماس با لوله های آهنی قرار گرفته باشد یافت می شود. آهن می تواند به شکل های گوناگون در آب پیدا شود : در محلولها به صورت مواد کلوئیدی معلق و به صورت کمپلکس با کانیها یا مواد آلی. این عنصر چندان مضر نیست ولی از نظر خواص ظاهری آب مناسب نمی باشد، زیرا چنانچه به مقدار زیاد در آب وجود داشته باشد مزه تلخی به آن داده و آب را ناگوارا می سازد. در صورتیکه آهن موجود در آب زیاد باشد در اثر قرار گرفتن در معرض هوا، اکسیژن را جذب کرده و در نتیجه ته نشین و ایجاد رنگ قهوه ای در محل اتصالات لوله کشی می نماید. حتی مقدار کم آهن می توان باعث جمع شدن رسوب در شبکه های آبرسانی شود که چنین رسوبی برای مصرف کننده مناسب نیست و باعث رشد باکتری های آهن شده که به نوبه خود سبب کاهش کیفیت آب از طریق تولید لجن و یا بوی غیرقابل تحمل می گردد. | 0/3 | 2 | -- |
| 8 | منگنز | میلی گرم در لیتر | منگنز حتی به مقدار کم عنصر زیان آوری در آب بشمار می آید. منگنز می تواند در حضور اکسیژن و یا پس از کلرزدن آب از آن جداشده و ته نشین گردد که در شبکه آبرسانی لایه لجنی سیاه رنگی تشکیل می دهد. این لایه لجنی گاهی از آب جدا شده و باعث ایجاد طعم بد و ظاهر ناخوشایند می شود. غلظت منگنز در آب چاه ها ندرتا از یک میلی گرم در لیتر افزون می گردد. با وجود این غلظت های بالاتری در اثر شرایط ویژه ای در آب های زیرزمینی پیدا می شود. اگر آب مخازن فاقد اکسیژن شود منگنز از ته نشین های کف آنها جدا شده و وارد آب می گردد. دگرگونی آب این مخازن در بهار و پاییز باعث افزایش منگنز در آب مصرفی می شود. عموما مقدار کمتری منگنز در مقایسه با آهن در آب سیستم آبرسانی موجود است، زیرا هر چند رسوب دادن منگنز به آهستگی انجام می شود ولی مداوم می باشد و به همین علت پس از سرویس شبکه آبرسانی امکان وقوع مساله ای جدی تا 10-14 سال بعد کم خواهد بود. دستورالعمل های مجمع اروپایی مقدار 0.02 میلی گرم در لیتر را بعنوان میزان راهنما و حداکثر غلظت مجاز را 0.005 میلی گرم در لیتر پیشنهاد می کند. | 0.4 | 1 | -- |
| 9 | مس | میلی گرم در لیتر | مس در آبهای آلوده نشده و طبیعی بندرت یافت می شود. هر چند گاهی نشانه هایی از آن در آبهای سبک اسیدی مناطق مردابی قابل تشخیص می باشد. نمکهای مس برای برای کنترل رشد جلبکها در مخازن آب بکار می روند و در نتیجه، این منبعی برای ورود مس در آب های سطحی بشمار می آید. مقدار 0.5 میلی گرم در لیتر نمک مس را بعنوان دوز اولیه و 1 تا 2 میلی گرم در لیتر بعنوان دوز بعدی به مدت یک روز بکار می برند. مسی که معمولا در آب مصرفی خانه ها پیدا می شود، از خورندگی مس و آلیاژهای آن که بعنوان لوله و اتصالات آن مصرف دارد، ناشی می گردد. مس بعنوان یک عنصر اصلی در غذای انسان بشمار می آید ولی در غلظت های بیش از 20 میلی گرم در لیتر برای سلامتی انسان مضر می باشد. مس در آب های جاری حدود 1 میلی گرم در لیتر یا کمتر می تواند در اتصالات لوله های آب منازل با ایجاد رنگ سبز رسوب نماید. میزان خورندگی فولاد گالوانیزه با حضور یک میلی گرم در لیتر می تواند افزایش یابد و مقدار 0.02 میلی گرم در لیتر آن می تواند در ظروف آلومینیومی ایجاد سوراخ نماید. طبق استاندارهای بین المللی سازمان بهداشت جهانی سال 1971 مناسب ترین غلظت مس در آب آشامیدنی 0.05 میلی گرم در لیتر بوده و بالاترین میزان مجاز آن 1.5 میلی گرم در لیتر می باشد. طبق دستورالعمل های مجمع اروپایی مقدار مس 0.01 میلی گرم در لیتر برای آب های تصفیه شده می باشد ولی تا میزان 3 میلی گرم در لیتر برای آب هایی که به مدت 12 ساعت در لوله های مسین قرار گرفته باشند، مجاز است و بیش از این مقدار مسائلی چون مزه، خورندگی و ایجاد رنگ سبزینه دنبال خواهد داشت. مس در مقادیر جزیی برای متابولیسم بدن مفید بوده و فقدان جزیی آن باعث کم خونی در اطفال می شود زیرا طبق مطالعات انجام شده مس بعنوان کاتالیزور در تشکیل هوگلوبین دخالت دارد. اطفال روزانه به ازای هر کیلو وزن بدنشان به 0.1 میلی گرم مس نیاز دارند. مس در غلظت موجود در آب های آشامیدنی سمی نیست ولی مصرف مداوم آب های مس دار ناراحتی کبدی تولید خواهد نمود. | 0.05 | 2 | -- |
| 10 | روی | میلی گرم در لیتر | روی به مقدار جزیی در آب های سطحی و زیر زمینی آلوده نشده یافت می شود. روی در نتیجه خورندگی تانک ها و لوله های از جنس آهن گالوانیزه و اتصالات برنجی وارد آب های آشامیدنی می گردد. غلظت هایی از روی که معمولا در آب آشامیدنی یافت می شود برای سلامتی انسان مضر نمی باشد. حد آستانه طعم روی تقریبا 5 میلی گرم در لیتر می باشد. | 3 | 5 | -- |
| 11 | آرسنیک | میلی گرم در لیتر | آرسنیک عنصری سمی است که اگر در آب پیدا شود باید به آن توجه و دقت لازم بشود. حداکثر غلظت مجاز آرسنیک در آب آشامیدنی 0.05 میلی گرم در لیتر است که هماهنگ با مقادیر مجاز از نظر زهرشناسی می باشد. آرسنیک در آب های سطحی و در مناطقی که معادن سنگ فلزات آهنی وجود دارد، یافت می شود و در بیشتر مواقع در نتیجه مصرف مواد ضد آفات نباتی، حشره کش ها که حاوی آرسنیک می باشند و همچنین از طریق پس مانده های معادن وارد آب می گردد. استاندارهای بین المللی سازمان بهداشت جهانی سال 1971، چنین اظهار می دارد که ارقام بزرگتری از آنچه در استاندارها آمده است در تعدادی از کشورهای آمریکای لاتین بدست آمده و تاکنون میزان تا 0.2 میلی گرم در لیتر اشکالاتی بوجود نیاورده است. آرسنیک در گیاهان و موجودات آبی مانند میگو که اغلب جنبه غذایی برای انسان دارند، وجود دارد که در اثر مصرف این موجودات توسط انسان خودبخود وارد بدن شده و تجمع یافته و ایجاد مسمومیت می نماید. مهمترین اثرات مسموم کنندگی آرسنیک بی اشتهایی، کم شدن وزن بدن، اسهال، بهم خوردگی معده و ناراحتی های عصبی می باشد. در کارگرانی که بطور دائم با ترکیبات آرسنیک سروکار دارند، سرطان پوست و ریه دیده شده و از اینرو خاصیت سرطان زایی آن چندان بی پایه نیست. | 0.01 | 0.05 | 0.1 |
| 12 | سرب | میلی گرم در لیتر | سرب یکی از عناصر سمی قابل تجمع برای بدن بشمار می آید و طی سالیان بیشماری خطرات ناشی از آن باثبات رسیده است. مقدار سرب در غالب آب های طبیعی ندرتا بیش از 0.02 میلی گرم در لیتر می باشد، بجز در مناطقی که آب های اسیدی سبک با سنگ گالن ( سولفور سرب ) و یا سنگ های دیگر سرب در تماس قرار می گیرد. میزان سرب به اندازه 0.05 میلی گرم در لیتر در آب آشامیدنی، معادل تقریبا 25% دریافت روزانه سرب در آب بوسیله مصرف روزانه دو لیتر آب می باشد. منبع اصلی سرب در آب مصرفی از حل شدن آن در لوله کشی های قدیمی ناشی می شود. هر چند انحلال سرب در آب خیلی سبک اسیدی مناطق کوهستانی و مردابی بهتر انجام می گیرد.ولی در مناطق دارای آب سخت بویژه با سختی بیکربناتی نیز سرب در آب حل می گردد. بنابراین مقدار سرب آب آشامیدنی باید همواره در مناطقی که از شبکه لوله کشی سربی استفاده می شود، کنترل گردد. اگر ترکیبات سرب را بعنوان تثبیت کننده در انواع خاصی از لوله های پلاستیکی بکار برند، میزان غیر قابل قبولی از سرب در آب حل خواهد شد. حداکثر غلظت مجاز سرب 0.05 میلی گرم در لیتر می باشد. استاندارهای بین المللی سازمان بهداشت جهانی سال 1971، بطور آزمایشی مقدار سرب را از 0.05 به 0.1 میلی گرم در لیتر افزایش داده است. اغلب اعضا بدن سرب دارند ولی قسمت اعظم سرب بدن انسان در استخوان ها موجود است و در استخوان با کلسیم مبادله شده و ناراحتی استخوانی تولید می نماید. سرب موجود در استخوان در مواقع تب می تواند به سایر اعضای بدن انتقال یافته و ایجاد مسمومیت نماید. | 0.01 | 0.05 | 0.05 |
| 13 | جیوه | میلی گرم در لیتر | جیوه از طریق استخراج معادن جیوه، کارخانجات تهیه کلر و سود، کاغذسازی، پلاستیک سازی، تهیه دفع آفات نباتی و بیمارستان ها وارد محیط زیست انسان می شود. جیوه در محیط آبی به صورت جیوه فلزی و ترکیبات معدنی یا آلی آن وجود دارد. جیوه به شکل متیل مر کوری یا سایر ترکیبات در زنجیره غذایی از طریق تجمع در بدن موجودات آبزی وارد می شود. ترکیبات آلی جیوه بخصوص متیل مر کوری بسیار سمی تر از ترکیبات معدنی آن می باشند. عبور ترکیبات آلی جیوه از جفت و ورود آن به بدن جنین مساله بزرگی است که باعث ناهنجاری های شدید در طفل می شود. جیوه با گروه سولفیدریل آنزیم ها ترکیب می گردد. | 0.001 | 0.006 | 0.006 |
| 14 | سولفات | میلی گرم در لیتر | غلظت سولفات در آب های طبیعی از چند میلی گرم تا چند هزار میلی گرم در لیتر متغیر می باشد. سولفات از منابع مختلف می تواند در آب های سطحی و زیرزمینی نفوذ کند از جمله : حل شدن ژیپس ( سنگ گچ ) یا سایر رسوبات معدنی که حاوی سولفات می باشند، سولفات حاصل از آب دریا، اکسیداسیون سولفیدها، سولفیت ها و تیوسولفات ها در آبهای سطحی و فاضلاب های صنعتی درجایی که سولفات و اسید سولفوریک در صنایع بکار می روند مانند صنعت چرم سازی و تهیه خمیر کاغذ. گاز هیدروژن سولفوره از طریق دود کشهای کارخانجات صنعتی در فضا پخش شد، و باعث می شود که آب باران های این مناطق حاوی میزان محسوسی سولفات گردند. سولفات در آب آشامیدنی سهم عظیمی در سختی دائم یا غیرکربناتی دارد. غلظت بالای سولفات در تغییر طعم آب موثر بوده و اگر با کاتیون های منیزیم و سدیم ترکیب شده باشد اثر ملین دارد. در مناطقی که ساکنین آنها ناچار به مصرف آب های با غلظت بالای سولفات هستند و هیچگونه منبع آب دیگری در دسترس ندارند به غلظت بالای سولفات عادت می کنند و مساله ای برای آنها پیش نمی آید. احیای سولفات بوسیله باکتری های بی هوازی تولید هیدروژن سولفوره با بوی بد تخم مرغ گندیده می نماید. این گاز در آب چاههای عمیق نیز تولید می شود که با هوا دادن کافی بسرعت بوی آن برطرف می گردد. | 250 | 400 | 400 |
| 15 | ترکیبات فنل | میلی گرم در لیتر | ترکیبات فنلی که در آب های سطحی پیدا می شوند معمولا نتیجه آلودگی ناشی از فضولات صنایع مانند صنعت پتروشیمی، شستشوی حاصل از اسفالت جاده ها، گازهای مایع و سطوح قطرانی شده می باشد. ترکیبات فنلی طبیعی از تجزیه آلگ ها یا گیاهان عالی بدست می آیند. فنل ها در آب های زیر زمینی بخصوص در نواحی نفت خیز نیز وجود دارند. بیشتر ترکیبات فنلی در غلظت های کم با کلر حاصل از کلرینه کردن آب ترکیبات فنلی کلردار ( کلروفنل ها ) می دهند که در بو و طعم آب موثر می باشند. طبق استاندارهای بین المللی سازمان بهداشت جهانی سال 1971 حداکثر غلظتی از ترکیبات فنلی که مشکلی در آب ایجاد نمی کند 0.001 میلی گرم در لیتر می باشد. در تصفیه آب، ترکیبات فنلی را می توان بوسیله اکسیداسیون با ازن، کلرینه کردن زیاد آب و تجزیه شیمیایی آنها بوسیله سوپرکلریناسیون و جذب سطحی توسط ذغال فعال از آب جدا نمود. | 0.001 | 0.005 | 0.1 |
| 16 | آفت کش ها | میلی گرم در لیتر | سموم دفع آفات شامل ترکیباتی مثل حشره کش ها، علف کش ها، مواد ضد قارچ و مواد ضد جلبک می باشند. این مواد حاوی عناصر غیرآلی مثل سولفات مس، هیدروکربورهای کلردار مانند دیلدرین، آلدرین، لیندان و ترکیبات فسفره آلی مانند پاراتیون و مالاتیون و تعداد بسیار دیگری می باشند. ورود سموم دفع آفات به آب های طبیعی از طرق مختلف صورت می گیرد. بکار بردن مستقیم آن ها برای کنترل گیاهان و حشرات در آب، به علت عبور آب از زمین های کشاورزی و از فاضلاب های صنعتی. مواد آلی حتی در مقادیر کم بالقوه سمی هستند و بعضی از آن ها مانند هیدروکربورهای کلردار در برابر تجزیه شیمیایی و بیوشیمیایی خیلی مقاوم می باشند. بنابراین سموم دفع آفات در بدن تجمع یافته در دراز مدت اثر کرده و مشکلاتی را بوجود می آورند. از آنجایی که سموم دفع آفات و ضد جلبک در مورد کنترل آبزیان بکار می روند، می توانند سبب تجزیه گیاهان شده و اکسیژن آب را کم کنند که بدنبال کاهش اکسیژن آب مسایلی مانند حل شدن آهن و منگنز و در نتیجه تولید بو و طعم در آب بوجود می آید. مقادیری از سموم ضد آفات که در آب آشامیدنی وجود دارد در مقایسه با مواد غذایی ناچیز است. بسیاری از سموم دفع آفات و هیدروکربورهای کلردار خیلی سریع جذب رسوبات و یا مواد معلق می شوند و این خاصیت می تواند برای جدا کردن آنها در اعمال تصفیه آب از طریق روش انعقاد پس از رسوب کردن مواد معلق مورد استفاده قرار گیرد. روش بهتر جدا کردن این مواد از آب واکنش های اکسیداسیون از طریق ازن، کلر، دی اکسید کلرو یا پرمنگنات پتاسیم می باشد. البته در برخی موارد کاربرد کلر می تواند پاره ای از سموم دفع آفات را به مواد سمی تر تبدیل کند و یا ممکن است با بعضی حلال ها واکنش داده و تشکیل ترکیبات بودار دهد. برای بهتر جدا کردن این مواد می توان از جذب آنها بوسیله ذغال فعال استفاده کرد. پودر ذغال فعال ممکن است در مرحله آخر واحدهای تصفیه، بر روی صافی ها و یا شفاف کننده ها قرار داده شود و یا ذغال فعال گرانول شده در مرحله آخر صاف کردن بکار رود. ترجیح داده می شود که میزان سموم دفع آفات را قبل از تصفیه کردن آب محدود ساخت | در محدوده مقادیر ذکر شده در استاندارد ملی کیفیت آب آشامیدنی 1053# | در محدوده مقادیر ذکر شده در استاندارد ملی کیفیت آب آشامیدنی 1053# | در محدوده مقادیر ذکر شده در استاندارد ملی کیفیت آب آشامیدنی 1053# |
| 17 | BOD5 | میلی گرم در لیتر | این آزمایش دلالت بر اکسیژن لازم برای تجزیه بیوشیمیایی مواد آلی در آب و همچنین اکسیژن مورد نیاز به منظور اکسیداسیون مواد کانی مانند سولفیدها دارد. این آزمایش تجربی است و نیاز اکسیژن نسبی آب های سطحی، آب های آلوده به فاضلاب های خانگی و صنعتی را با یکدیگر مقایسه می نماید و تقلیدی از تصفیه خودبخود در آب های رودخانه و جویبارها می باشد. تجزیه مواد آلی بوسیله موجودات بیولوژیکی نیاز به اکسیژن دارد که می باید از آب گرفته شود، بنابراین اگر یک فاضلاب خانگی با BOD بالا وارد جریان رودخانه ای گردد، باعث می شود که اکسیژن آب به مصرف برسد و در نتیجه ماهی ها و گیاهان آبزی موجود در رودخانه از بین بروند. | کمتر از 3 | کمتر از 5 | کمتر از 7 |
| 18 | آمونیوم | میلی گرم در لیتر | آمونیاک یکی از اشکال ازت است که در آب آشامیدنی یافت می شود و معمولا بر حسب میلی گرم در لیتر ازت بیان می گردد. آمونیاک آزاد موجود در آب برحسب میزان ازت می تواند به صورت ازت آمونیاکی، آمونیاک نمک دار و یا آمونیاک آزاد وجود داشته باشد. ازت در اثر اکسیداسیون شیمیایی قوی مواد آلی موجود در آب حاصل می شود. ترکیبات آمونیاکی از منابع مختلف منشا می گیرند که بعضی از آنها مانند تجزیه گیاهان، بی خطر می باشد. آب های چاه های عمیق با کیفیت آب خوب، می تواند حاوی مقدار زیادی آمونیاک آزاد باشند که ممکن است در اثر احیای نیترات ها، یا بوسیله باکتری ها و یا گذر آب از لایه های سنگی زمین بوجود آمده باشد وجود آمونیاک در آب دلیلی بر آلودگی آن از طریق فاضلاب خانگی یا صنعتی می باشد. مقدار آمونیاک در آب پالایش نشده از نظر تعیین مقدار کلر برای گندزدایی حائز اهمیت است. در این مورد تا میزان سه میلی گرم در لیتر ازت آمونیاک را می توان صرف نظر نمود و در مورد مقادیر بیشتر معمولا باید منابع ترکیبات آمونیاکی را به منظور پایین نگه داشتن خطر آلودگی باکتریایی بیشتر بررسی نمود. میزان آمونیاک تا 0.4 میلی گرم در لیتر، در آب های تصفیه شده ای که وارد سیستم آبرسانی می گردد قابل قبول است، زیرا آمونیاک در برخی موارد همراه با کلر به صورت ترکیب کلراسین در مرحله نهایی تصفیه آب مورد استفاده قرار می گیرد. در این حالت رسوب بیشتری از مصرف کلر به تنهایی تشکیل می شود. | 0.05 | 1.5 | -- |
| 19 | اکسیژن محلول اشباع | درصد | بیش از 70 | بیش از 50 | بیش از 30 | |
| 20 | باریم | میلی گرم در لیتر | 0.1 | 1 | 1 | |
| 21 | سیانید | میلی گرم در لیتر | 0.05 | 0.05 | 0.07 | |
| 22 | سلنیم | میلی گرم در لیتر | 0.01 | 0.01 | 0.01 | |
| 23 | کادمیم | میلی گرم در لیتر | 0.003 | 0.005 | 0.005 | |
| 24 | کرم کل | میلی گرم در لیتر | 0.05 | 0.05 | 0.05 | |
| 25 | بر | میلی گرم در لیتر | 0.5 | 1 | 1 | |
| 26 | جامدات معلق کل | میلی گرم در لیتر | 25 | -- | -- | |
| 27 | ||||||
| 28 | ||||||
| 29 |
اثرات بعضی مواد شیمیایی و معدنی آب ها
مواد شیمیایی در آب ها اثرات مفید و زیان آوری بر روی انسان دارند. در جدول زیر به اثرات و نحوه ورودی بعضی از این مواد به آب ها اشاره می شود. اثرات عمده مواد معدنی و شیمیایی موجود در آب ها مخصوصا فلزات سنگین را می توان در چهار مورد زیر طبقه بندی کرد.
- اثرات سمی
- سرطان زایی
- اثرات ژنتیکی
- اثرات توارثی
در مورد حذف فلزات سنگین علاوه بر غشا اسمزی که اکثرا قادر به حذف 99 تا 99/5 درصد از آنهاست می توانیم از روش های اختلاط و انعقاد با ترکیبات آهن و آلومینیوم و یا تزریق آهک و اصلاح pH برای تبدیل فلزات به هیدروکسید قابل رسوب استفاده نماییم.
اثرات ناخالصی های آب
| نام مواد | عوارض ناشی از آن | منشا احتمالی |
|---|---|---|
| آنتی مون | افزایش کلسترول خون - کاهش گلوکز | فاضلاب پالایشگاه ها- صنایع سرامیک سازی |
| الیاف آزبست بزرگتر از 10 میکرون | افزایش ریسک ایجاد پولیپ خوش خیم روده | فرسایش لوله های آزبست سیمانی - فرسایش معادن آزبست |
| باریم | افزایش فشار خون | تخلیه فاضلاب حفاری فاضلاب تصفیه فلزات |
| بریلیوم | آسیب های روده ای | تخلیه فاضلاب صنایع فلزی و صنایع نظامی |
| کادمیوم | ناراحتی های کلیوی | خوردگی لوله ها، تخلیه فاضلاب تصفیه فلزات |
| کرم | ایجاد حساسیت های پوستی | تخلیه فاضلاب صنایع فولاد |
| مس | ناراحتی روده - ناراحتی های کبد و کلیه | نشت از معادن - تخلیه فاضلاب صنایع مسی |
| سیانور | ناراحتی های عصبی و تیروئید | تخلیه صنایع آبکاری و پلاستیک سازی |
| فلوئور | ناراحتی های استخوانی - رنگارنگ شدن دندان ها | مصرف خمیر دندان - صنایع آلومینیوم |
| سرب | اختلال رشد جسمی و ذهنی کودکان - افزایش فشار خون و ناراحتی کلیه | خوردگی لوله ها - فرسایش معادن سرب |
| جیوه | بیماری های کلیه | تخلیه فاضلاب پالایشگاه ها و نشت معادن |
| سلنیم | ریزش مو و ناخن - بی حسی انگشتان - ناراحتی عمومی | نشت فاضلاب معادن - تخلیه فاضلاب پالایشگاه ها |

